Selasa, 19 November 2013
Senin, 18 November 2013
MATEMATIKA
Rumus Jumlah dan Selisih Sudut
Dari gambar segitiga ABC berikut:
AD = b.sin α
BD = a.sin β
CD = a.cos β = b.cos α

Untuk mencari cos(α+β) = sin (90 – (α+β))°

Untuk fungsi tangens:

Sehingga, rumus-rumus yang diperoleh adalah:

Rumus Sudut Rangkap

Sehingga, rumus-rumus yang diperoleh adalah:

Penurunan dari rumus cos2α:

Rumus Perkalian Fungsi Sinus dan Kosinus
Dari rumus-rumus jumlah dan selisih dua sudut dapat diturunkan rumus-rumus baru sebagai berikut:
Sehingga, rumus-rumus yang diperoleh:

Rumus Jumlah dan Selisih Fungsi Sinus dan Kosinus
Dari rumus perkalian fungsi sinus dan kosinus dapat diturunkan rumus jumlah dan selisih fungsi sinus dan kosinus.
Maka akan diperoleh rumus-rumus:

Contoh-contoh soal:
(1) Tanpa menggunakan daftar, buktikan bahwa:

(2) Buktikan bahwa dalam segitiga ABC berlaku:

FISIKA
Pengertian Kalor
Kalor didefinisikan sebagai energi panas yang dimiliki oleh suatu zat. Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit.
Dari hasil percobaan yang sering dilakukan besar kecilnya kalor yang dibutuhkan suatu benda(zat) bergantung pada 3 faktor
Q = m.c.(t2 – t1)
Dimana :
Q adalah kalor yang dibutuhkan (J)
m adalah massa benda (kg)
c adalah kalor jenis (J/kgC)
(t2-t1) adalah perubahan suhu (C)
Kalor dapat dibagi menjadi 2 jenis
Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu benda sebesar 1 derajat celcius.
H = Q/(t2-t1)
Kalor jenis adalah banyaknya kalor yang dibutuhkan untuk menaikkan suhu 1 kg zat sebesar 1 derajat celcius. Alat yang digunakan untuk menentukan besar kalor jenis adalah kalorimeter.
c = Q/m.(t2-t1)
Bila kedua persamaan tersebut dihubungkan maka terbentuk persamaan baru
H = m.c
Analisis grafik perubahan wujud pada es yang dipanaskan sampai menjadi uap. Dalam grafik ini dapat dilihat semua persamaan kalor digunakan.
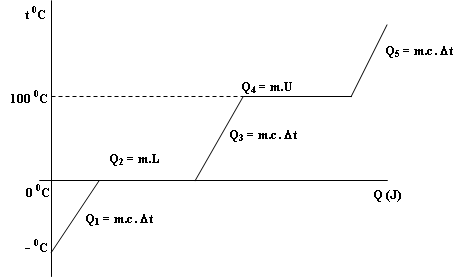
Keterangan :
Pada Q1 es mendapat kalor dan digunakan menaikkan suhu es, setelah suhu sampai pada 0 C kalor yang diterima digunakan untuk melebur (Q2), setelah semua menjadi air barulah terjadi kenaikan suhu air (Q3), setelah suhunya mencapai suhu 100 C maka kalor yang diterima digunakan untuk berubah wujud menjadi uap (Q4), kemudian setelah berubah menjadi uap semua maka akan kembali terjadi kenaikan suhu kembali (Q5)
Untuk mencoba kemampuan silakan kkerjakan latihan soal dengan cara klik disini.
Hubungan antara kalor dengan energi listrik
Kalor merupakan bentuk energi maka dapat berubah dari satu bentuk kebentuk yang lain. Berdasarkan Hukum Kekekalan Energi maka energi listrik dapat berubah menjadi energi kalor dan juga sebaliknya energi kalor dapat berubah menjadi energi listrik. Dalam pembahasan ini hanya akan diulas tentang hubungan energi listrik dengan energi kalor. Alat yang digunakan mengubah energi listrik menjadi energi kalor adalah ketel listrik, pemanas listrik, dll.
Besarnya energi listrik yang diubah atau diserap sama dengan besar kalor yang dihasilkan. Sehingga secara matematis dapat dirumuskan.
W = Q
Untuk menghitung energi listrik digunakan persamaan sebagai berikut :
W = P.t
Keterangan :
W adalah energi listrik (J)
P adalah daya listrik (W)
t adalah waktu yang diperlukan (s)
Bila rumus kalor yang digunakan adalah Q = m.c.(t2 – t1) maka diperoleh persamaan ;
P.t = m.c.(t2 – t1)
Yang perlu diperhatikan adalah rumus Q disini dapat berubah-ubah sesuai dengan soal.
Asas Black
Menurut asas Black apabila ada dua benda yang suhunya berbeda kemudian disatukan atau dicampur maka akan terjadi aliran kalor dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Aliran ini akan berhenti sampai terjadi keseimbangan termal (suhu kedua benda sama). Secara matematis dapat dirumuskan :
Q lepas = Q terima
Yang melepas kalor adalah benda yang suhunya tinggi dan yang menerima kalor adalah benda yang bersuhu rendah. Bila persamaan tersebut dijabarkan maka akan diperoleh :
Q lepas = Q terima
m1.c1.(t1 – ta) = m2.c2.(ta-t2)
Catatan yang harus selalu diingat jika menggunakan asasa Black adalah pada benda yang bersuhu tinggi digunakan (t1 – ta) dan untuk benda yang bersuhu rendah digunakan (ta-t2). Dan rumus kalor yang digunakan tidak selalu yang ada diatas bergantung pada soal yang dikerjakan.
Kalor didefinisikan sebagai energi panas yang dimiliki oleh suatu zat. Secara umum untuk mendeteksi adanya kalor yang dimiliki oleh suatu benda yaitu dengan mengukur suhu benda tersebut. Jika suhunya tinggi maka kalor yang dikandung oleh benda sangat besar, begitu juga sebaliknya jika suhunya rendah maka kalor yang dikandung sedikit.
Dari hasil percobaan yang sering dilakukan besar kecilnya kalor yang dibutuhkan suatu benda(zat) bergantung pada 3 faktor
- massa zat
- jenis zat (kalor jenis)
- perubahan suhu
Q = m.c.(t2 – t1)
Dimana :
Q adalah kalor yang dibutuhkan (J)
m adalah massa benda (kg)
c adalah kalor jenis (J/kgC)
(t2-t1) adalah perubahan suhu (C)
Kalor dapat dibagi menjadi 2 jenis
- Kalor yang digunakan untuk menaikkan suhu
- Kalor yang digunakan untuk mengubah wujud (kalor laten), persamaan yang digunakan dalam kalor laten ada dua macam Q = m.U dan Q = m.L. Dengan U adalah kalor uap (J/kg) dan L adalah kalor lebur (J/kg)
Kapasitas kalor adalah banyaknya kalor yang diperlukan untuk menaikkan suhu benda sebesar 1 derajat celcius.
H = Q/(t2-t1)
Kalor jenis adalah banyaknya kalor yang dibutuhkan untuk menaikkan suhu 1 kg zat sebesar 1 derajat celcius. Alat yang digunakan untuk menentukan besar kalor jenis adalah kalorimeter.
c = Q/m.(t2-t1)
Bila kedua persamaan tersebut dihubungkan maka terbentuk persamaan baru
H = m.c
Analisis grafik perubahan wujud pada es yang dipanaskan sampai menjadi uap. Dalam grafik ini dapat dilihat semua persamaan kalor digunakan.
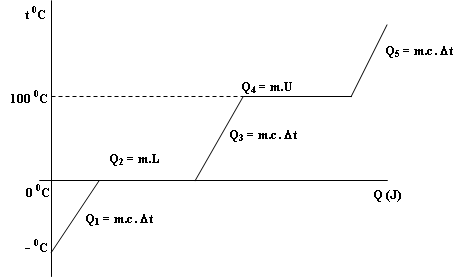
Keterangan :
Pada Q1 es mendapat kalor dan digunakan menaikkan suhu es, setelah suhu sampai pada 0 C kalor yang diterima digunakan untuk melebur (Q2), setelah semua menjadi air barulah terjadi kenaikan suhu air (Q3), setelah suhunya mencapai suhu 100 C maka kalor yang diterima digunakan untuk berubah wujud menjadi uap (Q4), kemudian setelah berubah menjadi uap semua maka akan kembali terjadi kenaikan suhu kembali (Q5)
Untuk mencoba kemampuan silakan kkerjakan latihan soal dengan cara klik disini.
Hubungan antara kalor dengan energi listrik
Kalor merupakan bentuk energi maka dapat berubah dari satu bentuk kebentuk yang lain. Berdasarkan Hukum Kekekalan Energi maka energi listrik dapat berubah menjadi energi kalor dan juga sebaliknya energi kalor dapat berubah menjadi energi listrik. Dalam pembahasan ini hanya akan diulas tentang hubungan energi listrik dengan energi kalor. Alat yang digunakan mengubah energi listrik menjadi energi kalor adalah ketel listrik, pemanas listrik, dll.
Besarnya energi listrik yang diubah atau diserap sama dengan besar kalor yang dihasilkan. Sehingga secara matematis dapat dirumuskan.
W = Q
Untuk menghitung energi listrik digunakan persamaan sebagai berikut :
W = P.t
Keterangan :
W adalah energi listrik (J)
P adalah daya listrik (W)
t adalah waktu yang diperlukan (s)
Bila rumus kalor yang digunakan adalah Q = m.c.(t2 – t1) maka diperoleh persamaan ;
P.t = m.c.(t2 – t1)
Yang perlu diperhatikan adalah rumus Q disini dapat berubah-ubah sesuai dengan soal.
Asas Black
Menurut asas Black apabila ada dua benda yang suhunya berbeda kemudian disatukan atau dicampur maka akan terjadi aliran kalor dari benda yang bersuhu tinggi menuju benda yang bersuhu rendah. Aliran ini akan berhenti sampai terjadi keseimbangan termal (suhu kedua benda sama). Secara matematis dapat dirumuskan :
Q lepas = Q terima
Yang melepas kalor adalah benda yang suhunya tinggi dan yang menerima kalor adalah benda yang bersuhu rendah. Bila persamaan tersebut dijabarkan maka akan diperoleh :
Q lepas = Q terima
m1.c1.(t1 – ta) = m2.c2.(ta-t2)
Catatan yang harus selalu diingat jika menggunakan asasa Black adalah pada benda yang bersuhu tinggi digunakan (t1 – ta) dan untuk benda yang bersuhu rendah digunakan (ta-t2). Dan rumus kalor yang digunakan tidak selalu yang ada diatas bergantung pada soal yang dikerjakan.
BIOLOGI
SISTEM EKSKRESI PADA MANUSIA
Ekskresi merupakan proses pengeluaran zat2 sisa dari dalam tubuh yang dihasilkan dari proses metabolisme. Sistem ekskresi pada manusia melibatkan alat-alat ekskresi yaitu ginjal, kulit, paru-paru, dan hati. Ginjal mengeluarkan urine, kulit mengeluarkan keringat, paru-paru mengeluarkan karbondioksida dan uap air, dan hati mengeluarkan zat warna empedu
A. Ginjal
1. Filtrasi (Penyaringan)
2. Reabsorbsi (Penyerapan Kembali)
3. Augmentasi (Pengumpulan)
C. Kulit
Kulit merupakan jaringan yang terdapat pada bagian luar tubuh. Kulit memiliki banyak fungsi karena
di dalamnya terdapat berbagai jaringan.
D. Paru-paru
Pembahasan tentang organ paru- paru sudah banyak dibahas pada pokok bahasan sistem pernapasan. Selain berfungsi sebagai alat pernapasan, paru-paru juga berfungsi sebagai alat ekskresi.
Paru-paru mengeluarkan zat sisa yang berupa CO2 dan uap air. pertukaran CO2 yang dikeluarkan tubuh dengan O2 yang diserap tubuh terjadi di Alveolus.
E. Hati
Organ hati sudah kita singgung pada pokok bahasan sistem pencernaan. Dari beberapa fungsi hati, yang terkait dengan fungsi ekskresi adalah :
1. Menghasilkan Getah Empedu
2. Menghasilkan Urea
F. Kelainan dan Penyakit pada Sistem Ekskresi
1. Gagal Ginjal
2. Batu Ginjal
3. Diabetes Insipidus
4. Nefritis (Radang Ginjal)
Ekskresi merupakan proses pengeluaran zat2 sisa dari dalam tubuh yang dihasilkan dari proses metabolisme. Sistem ekskresi pada manusia melibatkan alat-alat ekskresi yaitu ginjal, kulit, paru-paru, dan hati. Ginjal mengeluarkan urine, kulit mengeluarkan keringat, paru-paru mengeluarkan karbondioksida dan uap air, dan hati mengeluarkan zat warna empedu
A. Ginjal
manusia mempunyai sepasang ginjal yang
terletak di dalam rongga perut bagian belakang. Apabila sebuah ginjal
dipotong secara melintang maka akan tampak tiga lapisan.
Bagian luar disebut korteks atau kulit ginjal, di bawahnya ada medula atau sumsum ginjal dan di bagian dalam
berupa rongga yang disebut pelvis renalis atau rongga ginjal. Pelvis renalis atau rongga ginjal berupa rongga
yang berfungsi sebagai penampung urine
sementara sebelum dikeluarkan melalui ureter. Ginjal terdiri dari
jutaan alat penyaring darah yang disebut nefron. Nefron adalah satuan
struktural dan fungsional ginjal. di bawah ini merupakan gambar dari
nefron :
Pada bagian korteks atau kulit
ginjal terdapat glomerulus dan simpai Bowman (kapsula Bowman).
Glomerulus dan simpai Bowman membentuk kesatuan yang disebut Badan
Malpighi. Pada bagian inilah proses penyaringan darah (filtrasi)
dimulai. Badan malpighi merupakan awal dari nefron. Dari badan Malpighi
terbentuk saluran yang menuju bagian medula (sumsum ginjal). Medula
(sumsum ginjal) tersusun atas saluran-saluran yang merupakan kelanjutan
badan malphigi.
Fungsi ginjal adalah menyaring darah
yang hasil akhirnya berupa urine, urine dihasilkan melalui tiga tahapan.
Tiga tahap pembentukan urine tersebut adalah:
1. Filtrasi (Penyaringan)
Proses ini terjadi di glomerulus.
Cairan yang tersaring ditampung oleh simpai Bowman. Cairan tersebut
tersusun oleh urea, glukosa, air, ion-ion anorganik seperti natrium
kalium, kalsium, dan klor. Darah dan protein tetap tinggal di dalam
kapiler darah karena tidak dapat menembus pori–pori glomerulus. Cairan
yang tertampung di simpai Bowman disebut urine primer. Selama 24 jam
darah yang tersaring dapat mencapai 170 liter.
2. Reabsorbsi (Penyerapan Kembali)
Proses ini terjadi di tubulus
kontortus proksimal. Proses yang terjadi adalah penyerapan kembali zat-
zat yang masih dapat diperlukan oleh tubuh. Zat yang diserap kembali
adalah glukosa, air, asam amino dan ion-ion anorganik. Sedangkan urea
hanya sedikit diserap kembali. Cairan yang dihasilkan dari proses
reabsorbsi disebut urine sekunder.
3. Augmentasi (Pengumpulan)
Proses ini terjadi di tubulus
kontortus distal dan juga di saluran pengumpul. Pada bagian ini terjadi
pengumpulan cairan dari proses sebelumnya. Di bagian ini juga masih
terjadi penyerapan ion natrium, klor serta urea. Selain itu di bagian
ini juga terjadi penambahan zat2 yang bersifat racun bagi tubuh. Cairan
yang dihasilkan sudah berupa urine sesungguhnya, yang kemudian
disalurkan ke rongga ginjal (pelvis renalis). Urine yang sudah terbentuk
dan terkumpul di rongga ginjal dibuang keluar tubuh melalui ureter
kemudian ditampung di kandung kemih dan dan saat dikeluarkan melalui
uretra.
C. Kulit
Kulit merupakan jaringan yang terdapat pada bagian luar tubuh. Kulit memiliki banyak fungsi karena
di dalamnya terdapat berbagai jaringan.
Kulit terdiri atas tiga lapisan yaitu epidermis, dermis dan jaringan ikat bawah kulit.
1. Epidermis (Kulit Ari)
Epidermis tersusun oleh sejumlah lapisan sel yang pada dasarnya terdiri atas dua lapisan yaitu :
a. Lapisan tanduk
Merupakan lapisan epidermis paling luar. Pada lapisan ini tidak terdapat pembuluh darah dan
serabut saraf, karena merupakan sel-sel mati dan selalu mengelupas.
b. Lapisan malpighi
Lapisan ini terdapat di bawah lapisan tanduk. Sel-selnya terdapat pigmen yang menentukan warna kulit.
2. Dermis (Kulit Jangat)
Merupakan lapisan kulit di bawah epidermis, di dalam lapisan ini terdapat beberapa jaringan yaitu :
a. Kelenjar keringat, yang berfungsi untuk menghasilkan keringat. Keringat tersebut bermuara pada pori-pori kulit.
b. Kelenjar minyak, yang berfungsi untuk menghasilkan minyak guna menjaga rambut tidak
kering. Kelenjar ini letaknya dekat akar rambut.
c. Pembuluh darah, yang berfungsi untuk mengedarkan darah ke semua sel atau jaringan
termasuk akar rambut.
d. Ujung-ujung saraf. Ujung saraf yang terdapat pada lapisan ini adalah ujung saraf perasa dan peraba.
3. Jaringan Ikat Bawah Kulit
Di bagian ini terdapat jaringan lemak (adiposa). Fungsinya antara lain untuk penahan suhu tubuh dan cadangan makanan.
Dengan adanya berbagai jaringan yang terdapat di dalamnya, maka kulit dapat berfungsi sebagai :
1. indra peraba dan perasa,
2. pelindung tubuh terhadap luka dan kuman,
3. tempat pembentukan vitamin D dari provitamin D dengan bantuan sinar ultraviolet cahaya matahari,
4. penyimpan kelebihan lemak,
5. pengatur suhu tubuh.
Dari berbagai fungsi tersebut
yang berkaitan dengan sistem ekskresi adalah kemampuan kulit sebagai
pengatur suhu tubuh. Suhu tubuh diatur oleh pusat pengatur panas di
sumsum lanjutan agar konstan 36o – 37,5o C. Bila
suhu badan meningkat, maka kapiler darah melebar, kulit menjadi panas
dan kelebihan panas dipancarkan ke kelenjar keringat. Sehingga terjadi
penguapan cairan dalam bentuk keringat pada permukaan tubuh. Sebaliknya
bila tubuh merasa kedinginan, pembuluh darah mengkerut, kulit menjadi
pucat dan dingin, keringat dibatasi pengeluarannya.
Keringat yang dikeluarkan oleh kelenjar keringat berisi larutan garam, urea dan air. Banyaknya keringat
yang dikeluarkan tergantung dari beberapa faktor antara lain aktivitas tubuh, suhu lingkungan, makanan, kesehatan dan emosi.
D. Paru-paru
Pembahasan tentang organ paru- paru sudah banyak dibahas pada pokok bahasan sistem pernapasan. Selain berfungsi sebagai alat pernapasan, paru-paru juga berfungsi sebagai alat ekskresi.
Paru-paru mengeluarkan zat sisa yang berupa CO2 dan uap air. pertukaran CO2 yang dikeluarkan tubuh dengan O2 yang diserap tubuh terjadi di Alveolus.
E. Hati
Organ hati sudah kita singgung pada pokok bahasan sistem pencernaan. Dari beberapa fungsi hati, yang terkait dengan fungsi ekskresi adalah :
1. Menghasilkan Getah Empedu
Getah empedu dihasilkan dari hasil perombakan sel darah merah. Getah ini ditampung di dalam
kantung
empedu kemudian disalurkan ke usus 12 jari. Getah empedu pada dasarnya
terdiri atas dua komponen yaitu garam empedu dan zat warna empedu. Garam
empedu berfungsi dalam proses pencernaan makanan yaitu untuk mengemulsi
lemak. Sedangkan zat warna empedu tidak berfungsi sehingga harus
diekskresikan. Zat warna empedu yang diekskresikan keusus 12 jari,
sebagian menjadi sterkobilin, yaitu zat yang mewarnai feses dan beberapa
diserap kembali oleh darah dibuang melalui ginjal sehingga membuat
warna pada urine yang disebut urobilin. Kedua zat ini mengakibatkan warna feses dan urine kuning kecoklatan.
2. Menghasilkan Urea
Urea adalah salah satu zat hasil
perombakan protein. Karena zat ini beracun bagi tubuh maka harus dibuang
keluar tubuh. Dari hati urea diangkut ke ginjal untuk dikeluarkan
bersama urine.
F. Kelainan dan Penyakit pada Sistem Ekskresi
1. Gagal Ginjal
Gagal ginjal adalah kelainan ginjal
yang tidak berfungsi sebagaimana mestinya (sebagai alat penyaring
darah). Penderita gagal ginjal dapat ditolong dengan cuci darah secara
berkala. Dengan menggunakan alat yang disebut dialisator. Namun alat ini
tidak bisa memperbaiki kerusakan ginjal yang tetap/permanen. Penderita
gagal ginjal tetap dapat ditolong dengan mencangkok ginjal. Ginjal sakit
yang dimiliki penderita biasanya diambil. Kemudian ginjal yang sakit
tersebut diganti ginjal yang sehat dari donor yang sesuai.
2. Batu Ginjal
Batu ginjal terbentuk karena adanya
endapan garam kalsium yang makin lama makin mengeras dan membesar.
Endapan ini pada mulanya terdapat di rongga ginjal, kemudian terbawa
arus urine, juga terdapat di ureter dan kantong kemih. Batu ginjal dapat
dihilangkan dengan beberapa cara antara lain dengan pengobatan, yaitu
mengkonsumsi obat yang dapat menghancurkan batu ginjal. Namun bila
dengan pengobatan sulit hancur dapat dilakukan dengan pembedahan untuk
mengambil batu ginjal tersebut.
Diabetes insipidus adalah suatu
penyakit yang penderitanya mengeluarkan urine terlalu banyak. Penyebab
penyakit ini adalah kekurangan hormon ADH (Anti Diuretic Hormone), yaitu
hormon yang mempengaruhi proses reabsorbsi cairan pada ginjal. Bila
kekurangan hormon ADH, jumlah urine dapat meningkat sampai 30 kali
lipat.
4. Nefritis (Radang Ginjal)
Nefritis adalah peradangan pada nefron terutama glomerulus. Penyebabnya adalah infeksi bakteri Streptococcus.
KIMIA
LAJU REAKSI KIMIA
Suatu reaksi dapat terjadi bila antar zat-zat yang terlibat reaksi saling bertumbukan (terjadi kontak fisik antara yang satu dengan yang lain), namun tidak semua tumbukan tersebut menghasilkan reaksi, sebab partikel-partikel yang bertumbukan harus mempunyai energi yang cukup untuk memutuskan ikatan-ikatan.
Keterangan :
Waktu (t) yang diperlukan untuk terjadinya suatu reaksi berbanding terbalik dengan peningkatan kecepatan. Atau dengan kata lain semakin meningkat suhu maka waktu yang diperlukan juga semakin singkat :
Efek dari Katalis pada Laju Reaksi
Katalis adalah suatu zat yang mempercepat suatu laju reaksi dengan cara memberikan jalan lain terjadinya reaksi yang memiliki energi aktivasi yang lebih rendah sehingga reaksi tersebut lebih mudah terjadi. Namun zat katalis struktur kimianya pada akhir reaksi tidak mengalami perubahan. Selain itu ketika reaksi selesai, kita akan mendapatkan massa katalasis yang sama sesuai dengan massa awalnya ketika zat tersebut ditambahkan. Sehingga katalis dianggap tidak bereaksi. Zat-zat yang sering digunakan sebagai katalis adalah logam-logam golongan transisi atau senyawa-senyawanya. Otokatalis adalah katalis yang dihasilkan oleh reaksi itu sendiri.
Mengukur laju reaksi
Maka bentuk persamaan reaksinya adalah :
Keterangan :
b. Orde reaksi A = 2 dan B = 1, berarti ordereaksi totalnya = 3 dan bentuk persamaannya :
c. Orde reaksi A = 2 dan B = 0, berarti ordereaksi totalnya = 2 dan bentuk persamaannya :
Dengan mengetahui orde reaksi zat A dan B beserta konsentrasi tiap-tiap zat tersebut dan kecepatan reaksinya kita dapan menentukan nilai dari ketetapan laju reaksi (k) tersebut. Ketetapan laju sebenarnya tidak benar-benar konstan. Ketetapan ini dapat berubah-ubah, sebagai contoh, jika kita mengubah temperatur dari reaksi, menambahkan katalis atau merubah katalis. Jadi tetapan laju akan konstan untuk reaksi yang diberikan hanya apabila kita mengganti konsentrasi dari reaksi tersebut sedangkan temperatur dan tekanannya tidak berubah/konstan.
Dengan cara yang sama kita dapat mencari besarnya orde reaksi zat B. misalnya menggunakan data percobaan 1 dan 2 maka orde reaksi B = 1.
Terkadang data percobaan tidak terbentuk perbandingan yang pas misalnya besar v1 tidak sama dengan 6 melainkan 6,13 sedangkan v4 tidak sama dengan 24 melainkan 24,49. Maka harus kita bulatkan sehingga perbandingan akhirnya tetap 1 : 4.
Terkadang data percobaan yang ada terbatas. Misalnya data percobaan 1 dan 2 tidak ada, maka untuk mencari orde reaksi A kita tidak mengalami kesulitan karena kita bisa menggunakan data percobaan 4 dan 5 yang mempunyai nilai konsentrasi B yang sama.
Lalu….bagaimana jika kita mau mencari orde reaksi B ??
Yang terpenting untuk mencari orde reaksi B adalah harus menggunakan data percobaan yang nilai konsentrasi B nya tidak sama. Yaitu data percobaan 3 dan 4.
Terkadang juga data yang diketahui bukanlah kecepatan reaksi melainkan waktu reaksinya. Maka kita harus menggunakan perbandingan terbalik. Misalnya kita ingin mencari orde reaksi A dengan menggunakan data percobaan 1 dan 4 maka bentuk perbandingannnya :
Jadi persamaan reaksi di atas adalah :
Dengan menggunakan salah satu data percobaan kita dapat memperoleh besarnya nilai ketapannya (k), misalnya data percobaan 1 :
Suatu reaksi dapat terjadi bila antar zat-zat yang terlibat reaksi saling bertumbukan (terjadi kontak fisik antara yang satu dengan yang lain), namun tidak semua tumbukan tersebut menghasilkan reaksi, sebab partikel-partikel yang bertumbukan harus mempunyai energi yang cukup untuk memutuskan ikatan-ikatan.
Energi Aktivasi (Ea)
adalah adalah energi minimum yang diperlukan untuk melangsungkan
terjadinya suatu reaksi. Contohnya dalam reaksi endoterm dan eksoterm di
bawah ini :
Jadi baik dalam reaksi endoterm
(menyerap kalor) maupun eksoterm (melepas kalor) tetap butuh energi
aktivasi. Semakin rendah energi aktivasinya maka semakin mudah reksi
dapat berlangsung. Jika partikel-partikel bertumbukan dengan energi yang
lebih rendah dari energi aktivasi, maka tidak akan terjadi reaksi.
Mereka akan kembali ke keadaan semula. Bayangkanlah energi aktivasi
sebagai tembok dari reaksi. Hanya tumbukan yang memiliki energi sama
atau lebih besar dari aktivasi energi yang dapat menghasilkan terjadinya
reaksi.
Di dalam reaksi kimia, untuk
mencerai-beraikan ikatan kimia dibutuhkan energi dan untuk membentuk
ikatan-ikatan baru dilepaskan energi. Umumnya, ikatan-ikatan harus
diceraikan sebelum ikatan-ikatan yang baru terbentuk. Maka baik dalam
reaksi endoterm maupun eksoterm tetap dibutuhkan energi untuk
mencerai-beraikan ikatan-ikatan kimia untuk memulai terjadinya suatu
reaksi. Energi yang dibutuhkan inilah yang disebut sebagai energi aktivasi (Ea).
Ketika tumbukan-tumbukan tersebut relatif lemah, dan tidak cukup energi
untuk memulai proses penceraian ikatan. Hal ini mengakibatkan
partikel-partikel tersebut tidak bereaksi.
Faktor-faktor yang Mempercepat Reaksi
1. Memperluas permukaan zat padat.
2. Memperbesar konsentrasi (kepekatan) larutan.
3. Memperbesar tekanan (memampatkan volume wadah) gas.
4. Menaikkan suhu (memperbesar energi kinetiknya).
5. Menambahkan katalis (menurunkan energi aktivasi).
Efek dari Luas Permukaan pada Laju Reaksi
Semakin zat padat terbagi
menjadi bagian kecil-kecil, semakin cepat reaksi berlangsung. Bubuk zat
padat biasanya menghasilkan reaksi yang lebih cepat dibandingkan sebuah
bongkah zat padat dengan massa yang sama. Karena bubuk padat memiliki
luas permukaan yang lebih besar daripada sebuah bungkah zat padat.
Semakin luas permukaan suatu zat maka semakin besar kemungkinan
terjadinya tumbukan.
Efek dari Perubahan Konsenterasi Zat pada Laju Reaksi
Agar suatu reaksi dapat
berlangsung, partikel zat-zat yang bereaksi pertama-tama haruslah
bertumbukan. Jika konsentrasinya tinggi maka semakin mudah bertumbukan,
sehingga laju reaksinya akan bertambah.
Efek dari Perubahan Tekanan pada Laju Reaksi
Peningkatan tekanan pada reaksi
yang melibatkan gas pereaksi akan meningkatan laju reaksi. Perubahaan
tekanan pada suatu reaksi yang melibatkan hanya zat padat maupun zat
cair tidak memberikan perubahaan apapun pada laju reaksi. Peningkatan
tekanan dari gas akan berpengaruh pada peningkatan konsentrasi. Jika
Anda memilki gas dalam massa tertentu, semakin Anda meningkatkan tekanan
maka semakin kecil juga volumenya. Dan jika volumenya kecil sedangkan
massanya sama maka semakin tinggi konsentrasinya.
Efek dari Perubahan Suhu pada Laju Reaksi
Ketika Anda meningkatkan
temperatur maka laju reaksinya akan meningkat. Laju reaksi akan
berlipatganda setiap kenaikan suhu tertentu. Dan angka dari derajat suhu
yang diperlukan untuk melipatgandakan laju reaksi akan berubah secara
bertahap seiring dengan meningkatnya temperatur. Jika Anda memanaskan
suatu benda, maka partikel-partikelnya akan bergerak lebih cepat (energi
kinetiknya akan naik) sehingga frekuensi terjadinya tumbukan juga akan
meningkat.
Jika suhu dinaikkan a0C maka reaksi terjadi b kali lebih cepat (dalam soal nilai a biasanya = 100C dan nilai b = 2 kali). Laju reaksi saat suhunya dinaikkan dari T1 menjadi T2 (∆T) menjadi :
Keterangan :
Waktu (t) yang diperlukan untuk terjadinya suatu reaksi berbanding terbalik dengan peningkatan kecepatan. Atau dengan kata lain semakin meningkat suhu maka waktu yang diperlukan juga semakin singkat :
Efek dari Katalis pada Laju Reaksi
Katalis adalah suatu zat yang mempercepat suatu laju reaksi dengan cara memberikan jalan lain terjadinya reaksi yang memiliki energi aktivasi yang lebih rendah sehingga reaksi tersebut lebih mudah terjadi. Namun zat katalis struktur kimianya pada akhir reaksi tidak mengalami perubahan. Selain itu ketika reaksi selesai, kita akan mendapatkan massa katalasis yang sama sesuai dengan massa awalnya ketika zat tersebut ditambahkan. Sehingga katalis dianggap tidak bereaksi. Zat-zat yang sering digunakan sebagai katalis adalah logam-logam golongan transisi atau senyawa-senyawanya. Otokatalis adalah katalis yang dihasilkan oleh reaksi itu sendiri.
Ingat, katalais hanya
mempengaruhi laju pencapaian kesetimbangan, bukan posisi keseimbangan
(misalnya : membalikkan reaksi). Katalis tidak menggangu gugat hasil
suatu reaksi kesetimbangan.
Orde Reaksi dan Persamaan Laju
Mengukur laju reaksi
Laju
reaksi biasanya diukur dengan melihat seberapa cepat konsentrasi suatu
reaktan/pereaksi berkurang pada waktu tertentu. Atau dengan mengamati
seberapa cepat konsentrasi suatu produk/hasil reaksi bertambah pada
waktu tertentu. Berarti satuan laju reaksi adalah M/s (molaritas/sekon).
Orde Reaksi
Orde
reaksi selalu ditemukan melalui percobaan. Kita tidak dapat menentukan
apapun tentang orde reaksi dengan hanya mengamati persamaan dari suatu
reaksi. Dalam percobaan tersebut kita mengamati pengaruh penambahan
konsentrasi tiap-tiap reaktan/pereaksi terhadap laju reaksi. Jika
konsentrasi salah satu zat dinakkan menjadi a kali dan ternyata laju
reaksinya menjadi b kali, maka :
[a]orde = b
Dari pengambaran di atas, orde reaksi berupa bilangan pangkat dari konsentrasi
zat-zat yang bereaksi. Jadi andaikan kita telah melakukan beberapa
percobaan untuk menyelidiki apa yang terjadi dengan laju reaksi dimana
konsentrasi dari satu reaktan,misal namanya A, berubah, Beberapa hal-hal
yang akan kita temui adalah :
a. laju reaksi berbanding lurus dengan konsentrasi A
Hal
ini berarti jika kita melipatgandakan konsentrasi A, laju reaksi akan
berlipat ganda pula. JIka kita meningkatkan konsentrasi A menjadi dua
kali lipat maka laju reaksi pun akan menjadi 2 kali lipat. Yang berarti
orde reaksi terhadap A sama dengan satu.
b. laju reaksi berbanding lurus dengan kuadrat konsentrasi A
Hal
ini berarti jika kita melipatgandakan konsentrasi A, laju reaksi akan
berlipat menjadi kuadrat konsentrasi tersebut. JIka kita meningkatkan
konsentrasi A menjadi dua kali lipat maka laju reaksi pun akan menjadi
22 = 4 kali lipat. Yang berarti orde reaksi terhadap A sama dengan dua.
c. Laju reaksi tidak terpengaruh dengan konsentrasi A
Hal
ini berarti laju reaksi tidak terpengaruh oleh penambahan konsentrasi
A. Yang berarti orde reaksi terhadap A sama dengan nol (0).
Jika reaksi yang terjadi
melibatkan dua reaktan atau lebih maka tiap-tiap reaktan kita cari orde
reaksinya, kemuduan orde reaksi total merupakan hasil penjumlahan orde
reaksi dari tiap-tiap reaktan.
Persamaan Laju Reaksi
Pemahaman
tentang orde reaksi akan lebih jelas dalam bentuk persamaan reaksi.
Misialnya terjadi reaksi anrata zat A dan zat B sebagai berikut :
Maka bentuk persamaan reaksinya adalah :
Keterangan :
v = laju reaksi (M/s)
k = ketetapan laju reaksi
[A] = konsentrasi zat A (M)
[B] = konsentrasi zat B (M)
m = orde reaksi terhadap zat A
n = orde reaksi terhadap zat B
Orde Reaksi = m + n
Berikut ini disajikan beberapa contoh kasus yang dapat terjadi :
b. Orde reaksi A = 2 dan B = 1, berarti ordereaksi totalnya = 3 dan bentuk persamaannya :
c. Orde reaksi A = 2 dan B = 0, berarti ordereaksi totalnya = 2 dan bentuk persamaannya :
Dengan mengetahui orde reaksi zat A dan B beserta konsentrasi tiap-tiap zat tersebut dan kecepatan reaksinya kita dapan menentukan nilai dari ketetapan laju reaksi (k) tersebut. Ketetapan laju sebenarnya tidak benar-benar konstan. Ketetapan ini dapat berubah-ubah, sebagai contoh, jika kita mengubah temperatur dari reaksi, menambahkan katalis atau merubah katalis. Jadi tetapan laju akan konstan untuk reaksi yang diberikan hanya apabila kita mengganti konsentrasi dari reaksi tersebut sedangkan temperatur dan tekanannya tidak berubah/konstan.
Cara Menentukan Orde Reaksi
Orde reaksi dari suatu reaksi
dapat ditentukan melalui eksperimen. Eksperimen dilakukan dengan
mengubah-ubah konsentrasi salah satu zat yang bereaksi dengan cara
menaikkan/menurunkan konsentrasinya sedangkan konsentrasi zat-zat lain
dibuat tetap. Tiap-tiap perubahan konsentrasi yang terjadi kita amati
perubahan laju reaksinya atau waktu reaksinya. Misalnya data eksperimen
laju reaksi sebagai berikut :
Untuk mencari orde reaksi zat A
kita perlu membandingkan dua data percobaan yang konsentrasi zat B nya
tetap. Yakni kita pilih dua diantara percobaan 1, 4 dan 5. Tujuan dari
pemilihan konsentrasi B yang sama adalah agar perbandingan zat B nya
sama dengan 1 : 1, sehingga berapapun nilai orde reaksi B tetap
perbandingan zat B nya 1 : 1. Ingat angka satu dipangkatkan berapapun
nilainya tetap satu. Dalam contoh kali ini saya menggunakan percobaan ke
1 dan 4, maka perbandingan kedua percobaan tersebut adalah :
Dengan cara yang sama kita dapat mencari besarnya orde reaksi zat B. misalnya menggunakan data percobaan 1 dan 2 maka orde reaksi B = 1.
Terkadang data percobaan tidak terbentuk perbandingan yang pas misalnya besar v1 tidak sama dengan 6 melainkan 6,13 sedangkan v4 tidak sama dengan 24 melainkan 24,49. Maka harus kita bulatkan sehingga perbandingan akhirnya tetap 1 : 4.
Terkadang data percobaan yang ada terbatas. Misalnya data percobaan 1 dan 2 tidak ada, maka untuk mencari orde reaksi A kita tidak mengalami kesulitan karena kita bisa menggunakan data percobaan 4 dan 5 yang mempunyai nilai konsentrasi B yang sama.
Lalu….bagaimana jika kita mau mencari orde reaksi B ??
Yang terpenting untuk mencari orde reaksi B adalah harus menggunakan data percobaan yang nilai konsentrasi B nya tidak sama. Yaitu data percobaan 3 dan 4.
Terkadang juga data yang diketahui bukanlah kecepatan reaksi melainkan waktu reaksinya. Maka kita harus menggunakan perbandingan terbalik. Misalnya kita ingin mencari orde reaksi A dengan menggunakan data percobaan 1 dan 4 maka bentuk perbandingannnya :
Jadi persamaan reaksi di atas adalah :
Dengan menggunakan salah satu data percobaan kita dapat memperoleh besarnya nilai ketapannya (k), misalnya data percobaan 1 :
6 = k.[0,1]2.[0,1]
k = 6
sehingga persamaan reaksinya menjadi :
v = 6.[A]2.[B]
TIK
PERANGKAT
KERAS JARINGAN LOKAL
1. Network
Interface Card ( NIC )
NIC (Kartu antarmuka jaringan) adalah
perangkat penghubung yang dipasang pada
setiap komputer.
Kartu Jaringan yang banyak digunakan
adalah :
a. Kartu Ethernet
a. Kartu Ethernet
- Memiliki port untuk koneksi kabel koaksial.
- Konektor yang digunakan adalah BNC untuk kabel koaksial dan RJ-45 untuk kabel twisted pair.
- Juga memiliki konektor AUI yang dapat dikoneksikan dengan kabel koaksial, twisted pair, dan serat optik.
b. Konektor localtalk
- Digunakan untuk komputer Macintosh.
- Menggunakan sebuah kotak adapter khusus dan kabel yang terpasang ke port printer.
- Memiliki kekurangan dalam kecepatan transfer data.
- Hanya dapat beroperasi pada kecepatan 0,23 Mbps.
c. Kartu Token Ring
- Menggunakan port dengan tipe konektor 9 pin.
2.
Hub/Konsentrator
- Berfungsi untuk menyatukan kabel-kabel network dari setiap komputer client, server dan perangkat lainnya.
- Mempunyai beberapa port atau slot konektor dengan nomor urut.
- Hub dibagi menjadi 2 jenis yaitu hub pasif dan hub aktif.
- Topologi yang digunakan adalah topologi star dan menggunakan kabel twisted pair yang dihubungkan dengan hub.
- Hub yang beredar dipasaran, mulai dari hub port 8,12,24,32 dengan konektor RJ-45.
3. Kabel
- Berfungsi untuk menghubungkan satu komputer lainnya.
- Kabel terdiri dari 2 jenis, yaitu: Twisted pair terdiri dari UTP,STP dan Kabel koaksial terdiri dari thick koaksial,thin koaksial.
4.
Konektor
- Kabel twisted pair menggunakan konektor RJ-45 dan kabel koaksial menggunakan konektor BNC.
5. Router
- Berfungsi untuk menghubungkan jaringan LAN dengan internet dalam merutekan transmisi antara keduanya.
- Kelebihan Router adalah kemampuan mencari jalur yang terbaik dalam mentransmisikan pesan atau data dari alamat asal ke alamat tujuan.
- Router dapat mengetahui keseluruhan jaringan dengan mencari sisi yang paling sibuk dan mampu menarik data dari sisi yang sibuk tersebut sampai sisi bersih (tidak sibuk lagi).
Langganan:
Postingan (Atom)










.gif)

.gif)

.gif)
.gif)
.gif)
.gif)
.gif)



